Instrucción para uso: Zofran
Quiero esto, dame el precio
Forma de la dosis: Muestre todas las formas; Solución para inyección intravenosa e intramuscular; Jarabe; supositorios rectales; Pastillas para absorción; pastillas de Lyophilized
Sustancia activa: Ondansetron*
ATX
A04AA01 Ondansetron
Grupos farmacológicos:
Antiemético
Medicinas de Serotonergic
La clasificación (ICD-10) nosological
Náusea de R11 y vómitos: vómitos postvigentes; Náusea; Vómitos; los Vómitos en el período postvigente; los Vómitos de medicación; los Vómitos en el fondo de terapia de radiación; los Vómitos incontrolable; los Vómitos en terapia de radiación; vómitos persistentes; vómitos indomables; náusea postvigente; los Vómitos con quimioterapia; Vómitos de la génesis central; los Vómitos con quimioterapia cytotoxic; hipos persistentes; vómitos repetidos
Y43.1 reacciones Adversas en el uso terapéutico de antitumor antimetabolites: Tratamiento con mercaptopurine
Y43.2 reacciones Adversas en el uso terapéutico de preparaciones naturales antineoplastic
Y43.3 reacciones Adversas en el uso terapéutico de otras medicinas del antitumor
Z100 * la CLASE XXII práctica Quirúrgica: cirugía abdominal; adenomectomy; Amputación; Trombosis coronaria angioplasty; Angioplasty de las arterias de la carótida; tratamiento de piel antiséptico por heridas; Mano Antiséptica; Apendectomía; atherectomy; trombosis coronaria del globo angioplasty; histerectomía vaginal; La carretera de circunvalación coronaria; Intervenciones en la vagina y cerviz; Intervenciones en la vejiga; Intervención en la boca; Restauración y cirugía reconstructiva; higiene de mano de personal médico; cirugía de Gynecologic; intervención ginecológica; cirugía ginecológica; Hypovolemic sobresaltan durante operaciones; Desinfección de heridas purulentas; Desinfección de bordes de heridas; intervención diagnóstica; procedimientos diagnósticos; Diathermocoagulation Cervical; cirugía larga; la Sustitución de los catéteres de la fístula; Infección en cirugía ortopédica; válvula de corazón artificial; cystectomy; cirugía de consulta externa a corto plazo; operación a corto plazo; procedimientos quirúrgicos cortos; Krikotireotomiya; Pérdida de la sangre durante cirugía; la Sangría durante cirugía y en el período postvigente; Kuldotsentez; fotocoagulación de láser; coagulación de láser; coagulación de láser retinal; Laparoscopia; Laparoscopia en Ginecología; fístula de CSF; pequeñas operaciones ginecológicas; pequeños procedimientos quirúrgicos; Mastectomía y plástico subsecuente; mediastinotomy; operaciones microquirúrgicas en el oído; operación de Mukogingivalnye; suturar; cirugía menor; operación de neurosurgical; Inmovilización del globo ocular en cirugía oftálmica; testectomy; pancreatectomy; Perikardektomiya; El período de rehabilitación después de cirugía; El período de convalecencia después de cirugía; trombosis coronaria de Percutaneous transluminal angioplasty; Pleural thoracentesis; Pulmonía postvigente y posttraumática; Preparación para procedimientos quirúrgicos; Preparación para cirugía; Preparación de las manos del cirujano antes de cirugía; Preparación del colon para procedimientos quirúrgicos; Pulmonía de la aspiración postvigente en neurosurgical y cirugía torácica; náusea postvigente; sangría postvigente; granuloma postvigente; choque postvigente; El período postvigente temprano; myocardial revascularization; Radiectomy; Resección gástrica; resección del intestino; Resección uterina; Resección del hígado; enterectomy; Resección de parte del estómago; nueva oclusión del buque hecho funcionar; la Vinculación de tejidos durante procedimientos quirúrgicos; Retiro de suturas; Condición después de cirugía ocular; Condición después de cirugía; Condición después de cirugía en la cavidad nasal; Condición después de gastrectomy; Estado después de resección del intestino delgado; Condición después de tonsilectomía; Condición después de retiro del duodeno; Condición después de phlebectomy; cirugía vascular; Splenectomy; Esterilización de instrumentos quirúrgicos; Esterilización de instrumentos quirúrgicos; sternotomy; cirugía dental; intervención dental en tejidos periodontal; strumectomy; Tonsilectomía; Cirugía torácica; cirugía torácica; gastrectomy total; Transdermal trombosis coronaria intravascular angioplasty; resección de Transurethral; Turbinektomiya; Retiro de un diente; cirugía de la catarata; Retiro de quistes; tonsilectomía; Retiro de fibroids; Quitar los dientes primarios móviles; Quitar pólipos; Quitar diente roto; Retiro del cuerpo del útero; Retiro de suturas; Fístula likvoroprovodyaschih caminos; Frontoetmoidogaymorotomiya; infección quirúrgica; Cirugía de úlceras del miembro crónicas; Cirugía; La cirugía en el área anal; La cirugía en el colon; práctica quirúrgica; El procedimiento quirúrgico; intervenciones quirúrgicas; Cirugía en la extensión gastrointestinal; procedimientos quirúrgicos del tracto urinario; procedimientos quirúrgicos del sistema urinario; intervención quirúrgica del sistema genitourinary; procedimientos quirúrgicos del corazón; manipulación quirúrgica; cirugía; Cirugía en las venas; intervención quirúrgica; cirugía vascular; Cirugía de trombosis; Cirugía; cholecystectomy; resección gástrica parcial; histerectomía; trombosis coronaria de Percutaneous transluminal angioplasty; Percutaneous transluminal angioplasty; carretera de circunvalación de la arteria coronaria; Extirpación del diente; Extirpación de dientes de leche; pulpectomy; pulsative carretera de circunvalación cardiopulmonar; Extracción del diente; Extracción de dientes; extracción de la catarata; Electrocoagulation; intervención de endourological; episiotomy; Etmoidotomiya; Complicaciones después de extracción del diente
Curso de la Radioterapia de Z51.0: Suplemento a terapia de radiación externa; Irradiación del rayo X local; terapia de radiación; el edema cerebral se asoció con la terapia de radiación; Lesión en terapia de radiación; Radioterapia
Quimioterapia de Z51.1 para neoplasma: Cistitis hemorrhagic, causado por cytostatics; Urotoxicity de cytostatics
Composición y forma de liberación
Solución para inyección intravenosa e intramuscular 1 ml
Hidrocloruro de Ondansetron dihydrate 2.5 mg.
(En términos de 2 mg. ondansetron)
Sustancias auxiliares: ácidos de monohidrato cítrico; citrato de sodio; cloruro de sodio; agua para inyecciones
En ampollas de 2 o 4 ml, en un plástico del contorno de embalaje (paleta) 5 ampollas; En un paquete de cartón 1 paquete (paleta).
Pastillas para resorción 1 mesa.
Ondansetron 4 mg.; 8 mg.
Sustancias auxiliares: gelatina; Mannitol; Aspartame; Sodio methylhydroxybenzoate; Sodio propyl hydroxybenzoate; sabor de fresa; agua purificada
En la ampolla 10 PC.; En un paquete de cartón 1 ampolla.
Jarabe 5 ml
Hidrocloruro de Ondansetron dihydrate 5 mg.
(Equivalente a 4 mg. ondansetron)
Sustancias auxiliares: ácido anhidro cítrico; citrato de sodio dihydrate; Sodio benzoate; Una solución del sorbitol; sabor de fresa; agua purificada
En botellas de 50 ml, complete con una cuchara de medición; En el juego de la caja 1.
Supositorios para administración rectal 1 supp.
Ondansetron 16 mg.
Excipients: Witepsol S58
En la tira 1 supp.; En un paquete de cartón 1 o 2 tira.
Descripción de forma de la dosis
Solución para introducción intravenosa e IM: un líquido incoloro transparente, prácticamente libre de inclusiones extranjeras.
Las pastillas para resorción: redondo, blanco, convexo en un lado y piso en el otro.
Jarabe: líquido claro de incoloro a color amarillo claro con un olor característico de fresa.
Supositorios: blanco, liso, uniforme, formado como un cilindro con un final puntiagudo.
Efecto de Pharmachologic
Modo de acción - antiemético.
Pharmacodynamics
Ondansetron es un antagonista del receptor 5-HT3 selectivo. Las medicinas para quimioterapia cytostatic y radioterapia pueden causar un aumento del nivel de serotonin, que, activando vagal afferent fibras que contienen receptores 5-HT3, causa un reflejo que vomita. Ondansetron inhibe el aspecto de un reflejo que vomita bloqueando receptores 5-HT3 al nivel neuronal tanto del sistema nervioso central como del sistema nervioso periférico.
Pharmacokinetics
Ondansetron completamente se absorbe en el aparato digestivo después de la ingestión y se metaboliza primero pasan por el hígado. Cmax en el plasma se consigue aproximadamente 1.5 horas después de la inyección. Bioavailability aumenta algo con el consumo simultáneo de la comida, pero no cambia tomando antiácidos.
La distribución de ondansetron es lo mismo para la administración oral, IM y IV la introducción; T1 / 2 es aproximadamente 3 horas, en pacientes mayores puede alcanzar 5 horas, y con el fracaso renal severo - 15-20 horas. El volumen de distribución cuando la concentración de equilibrio se alcanza es aproximadamente 140 litros. La encuadernación a proteínas plasma - el 70-76%. Después de la inyección rectal, el ondansetron se determina en el plasma después de 15-60 minutos. La concentración de la sustancia activa aumenta en línea recta, Cmax se alcanza después de aproximadamente 6 horas y es 20-30 ng / ml. La reducción de la concentración plasma ocurre a un precio inferior que después de la inyección oral (debido a la absorción continuada). T1 / 2 - 6 horas. bioavailability absoluto en administración rectal - el 60%.
Del flujo sanguíneo sistémico, se elimina principalmente a consecuencia del metabolismo en el hígado, que ocurre con la participación de varios sistemas de la enzima. La ausencia de la enzima CYP2D6 (spartein-debrisoquine-type polimorfismo) no afecta el pharmacokinetics de ondansetron. En la forma sin alterar, menos del 5% de la dosis administrada se emite en la orina.
En dosis que exceden 8 mg., el contenido de la sangre aumenta desproporcionadamente, porque Cuando las dosis altas se administran oralmente, el metabolismo puede disminuir en el primer paso a través del hígado.
Los parámetros de Pharmacokinetic de ondansetron no cambian con la admisión repetida.
En pacientes con la insuficiencia renal moderada (Cl creatinine - 15-60 ml / minuto), tanto la autorización sistémica como la distribución del volumen de ondansetron se reducen, que causa un aumento pequeño y clínicamente insignificante de su T1 / 2 (hasta 5.4 h). El pharmacokinetics de ondansetron permanece prácticamente sin alterar en pacientes con la disfunción renal severa que están en la hemodiálisis crónica. En pacientes con el daño severo de la función del hígado, la autorización sistémica de ondansetron drásticamente disminuye, causando un aumento de su T1 / 2 (hasta 15-32 h), y bioavailability oral alcanza el 100% debido a una disminución en el metabolismo presistémico.
Grupos pacientes especiales
Suelo
El pharmacokinetics de ondansetron depende del sexo de los pacientes. Las mujeres tienen menos autorización sistémica y volumen de la distribución (las cifras se corrigen para el peso corporal) que para hombres.
Niños y adolescentes (de edad de 1 mes a 17 años)
En una investigación clínica, los niños de edad de 1 a 24 meses (51 pacientes) recibieron ondansetron en una dosis de 0.1 mg. / kilogramo o 0.2 mg. / kilogramo antes de la cirugía. En pacientes de edad de 1 a 4 meses, Cl era aproximadamente 30% menos que en pacientes de edad de 5 a 24 meses, pero comparable a esto en pacientes de edad de 3 a 12 años (con la corrección según el Cuerpo de peso). T1 / 2 en el grupo de pacientes a la edad de 1-4 meses hizo un promedio de 6.7 horas; En las categorías de edad 5-24 meses y 3-12 años - 2.9 horas. Los pacientes de edad a partir de 1 a 4 meses no necesitan el ajuste de la dosis, ya que ondansetron intravenoso diario es usado para tratar la náusea postvigente y vomitando en esta categoría de pacientes. Las diferencias en parámetros pharmacokinetic son en parte explicadas por un volumen más alto de la distribución en pacientes de edad de 1 a 4 meses.
En un estudio en niños de edad de 3-12 años (21 pacientes) quien se sometió a la cirugía planeada bajo la anestesia general, los valores de Cl absolutos y la distribución del volumen de ondansetron después de un single IV inyección en una dosis de 2 mg. (3 a 7 años) o 4 mg. (A partir de 8 a 12 años) se redujo en comparación con los valores en adultos. Ambos parámetros aumentaron en línea recta según el peso corporal, en pacientes de edad de 12 años, estos valores estaban cerca de aquellos en adultos. Ajustando los valores de liquidación y el volumen de la distribución, según el peso corporal, estos parámetros estaban cerca en categorías de edad diferentes. La dosis, tener en cuenta calculado el peso corporal (0.1 mg. / kilogramo, máximo a 4 mg.), compensa estos cambios y exposición del sistema de ondansetron en niños.
Una población pharmacokinetic análisis se realizó en 74 pacientes de edad de 6 a 48 meses que recibieron IV / d ondansetron en una dosis de 0.15 mg. / kilogramo cada 4 horas en cantidad de 3 dosis para la reducción de náusea y vómitos causado por la quimioterapia y en 41 pacientes a la edad de 1 a 24 meses después de que las intervenciones quirúrgicas administraron ondansetron en una dosis sola de 0.1 o 0.2 mg. / kilogramo. Basado en parámetros pharmacokinetic en este grupo para pacientes de edad de 1 a 48 meses, la administración de ondansetron IV en una dosis de 0.15 mg. / el kilogramo cada 4 horas en una cantidad de 3 dosis debería llevar a una exposición sistémica comparable a esto observado en El uso de la medicina en las mismas dosis en niños de edad de 5 a 24 meses con intervenciones quirúrgicas, así como en estudios anteriores en niños con el cáncer (de edad de 4 a 18 años) e intervención quirúrgica (de edad de 3 a 12 años).
Pacientes de edad avanzada
Los estudios han mostrado un aumento débil, clínicamente insignificante, dependiente de la edad de T1 / 2 ondansetron.
Pacientes con función renal perjudicada
En pacientes con el daño renal moderado (Cl creatinine 15-60 ml / minuto) con la administración ondansetron, tanto la autorización sistémica como el volumen de distribución ondansetron se redujeron, causando un aumento pequeño y clínicamente insignificante de T1 / 2 (hasta 5.4 H). Ondansetron pharmacokinetics con la administración intravenosa permaneció prácticamente sin alterar en pacientes con la disfunción renal severa en la hemodiálisis crónica (los estudios se condujeron entre sesiones de la hemodiálisis).
Pacientes con función de hepatic perjudicada
En pacientes con el daño severo de la función del hígado, la autorización sistémica de ondansetron disminuye dramáticamente con un aumento de T1 / 2 a 15-32 h.
Indicación para Zofran
Prevención y eliminación de náusea y vómitos causado por quimioterapia cytostatic o radioterapia;
Prevención y eliminación de náusea postvigente y vomitando (rp para IV y / o inyección, pastillas de resorción, jarabe).
Contraindicaciones
Hipersensibilidad frente a cualquier componente de la medicina;
embarazo;
lactancia;
Edad de niños (supositorios);
Los niños menos de 2 años de la edad (pastillas para resorción, jarabe - la seguridad y la eficacia no se han estudiado).
Además para la p-Real-Academia-de-Bellas-Artes para iv y soy la administración
Use con la precaución en pacientes con ritmo cardíaco y anormalidades de conducción, pacientes que reciben antiarrhythmics y beta-blockers y pacientes con desórdenes del electrólito significativos (muy raramente con la administración intravenosa de ZofranŽ los cambios de ECG pasajeros se registraron, incluso la prolongación del intervalo QT).
Efectos secundarios
Pastillas para resorción, jarabe, supositorios
Reacciones alérgicas: urticaria, bronchospasm, laryngospasm, angioedema, anaphylaxis.
De parte del sistema digestivo: hipo, sequedad de boca, estreñimiento o diarrea, una sensación ardiente en el ano y recto después de la introducción del supositorio; A veces - un aumento pasajero asymptomatic de la actividad de pruebas del hígado.
Del sistema cardiovascular: dolor en el pecho, en algunos casos - con depresión del segmento de S., arrhythmia, bradycardia, bajando tensión arterial.
Del sistema nervioso: dolor de cabeza, mareo, desórdenes de movimiento espontáneos y convulsiones.
Otro: una prisa de sangre a la cara, un sentimiento de calor, una perturbación temporal de agudeza visual, hypokalemia, hypercreatininaemia.
RR para IV e IM
Los acontecimientos adversos presentados abajo se clasifican según la frecuencia de acontecimiento. La frecuencia del acontecimiento se define así: muy a menudo - ≥1 / 10; A menudo - ≥1 / 100 y <1/10; A veces - ≥1 / 1000 y <1/100; Raramente - ≥1 / 10000 y <1/1000; Muy raramente - <1/10000, incluso mensajes individuales.
De parte del sistema inmunológico: raramente - reacciones de hipersensibilidad del tipo inmediato, en varios casos severos, incluso anaphylaxis.
Del sistema nervioso: muy a menudo - dolor de cabeza; A veces - convulsiones, desórdenes de motor (incluso síntomas extrapyramidal como dystonia, oculogic crisis (espasmo del ojo) y dyskinesia) en ausencia de consecuencias clínicas persistentes; Raramente - mareo durante un rápido IV inyección.
Del lado de los ojos: raramente - perturbaciones visuales pasajeras (visión borrosa), principalmente durante IV introducción; Muy raramente - ceguera pasajera, principalmente durante administración intravenosa. La mayor parte de casos de la ceguera sin peligro se resolvieron dentro de 20 minutos. La mayor parte de pacientes recibieron medicinas de la quimioterapia que contienen cisplatin. En algunos casos, la ceguera pasajera era de una génesis cortical.
Del sistema cardiovascular: a veces - arrhythmia, dolor en el pecho, como acompañado, y no acompañado por una disminución en el segmento de S., bradycardia, bajando tensión arterial; A menudo - un sentimiento de accesos repentinos de calor o accesos repentinos de calor; Muy raramente - cambios pasajeros del ECG, incluso prolongación del intervalo QT, principalmente con IV introducción.
Del sistema respiratorio, pecho y mediastinum: a veces - hipos.
Del aparato digestivo: a menudo - estreñimiento.
Del hígado y conductos de la bilis: a veces - los asymptomatic aumentan en muestras del hígado (principalmente observado en pacientes que reciben la quimioterapia con cisplatin).
Reacciones generales y locales: a menudo - reacciones locales en lugar en / en la introducción.
Interacción
No hay pruebas que ondansetron induce o inhibe el metabolismo de otras medicinas, a menudo prescribidas en la combinación con ello.
Ondansetron es metabolizado por varias enzimas del sistema cytochrome P450 (CYP3A4, CYP2D6 y CYP1A2). La inhibición o la disminución en la actividad de una de las enzimas son por lo general compensadas por otros, y por lo tanto una reducción significativa en la autorización total de ondansetron es improbable. Sin embargo, la precaución se requiere cuando combinado:
- con tal enzymatic inducers P450 (CYP2D6 y CYP1A2), como barbitúricos, carbamazepine, carisoprodol, glutetimide, griseofulvin, óxido de nitrógeno, papaverine, phenylbutazone, phenytoin (probablemente otro hydantoins), rifampicin, tolbutamide;
Con tales inhibidores de enzimas P450 (CYP2D6 y CYP1A2) como allopurinol, macrolide antibióticos, antidepresivos de MAO, chloramphenicol, cimetidine, anticonceptivos orales que contienen estrógenos, diltiazem, disulfiram, valproic ácido, sodio valproate, erythromycin, fluconazole, fluoroquinolones, isoniazid, Ketoconazole, lovastatin, metronidazole, omeprazole, propranolol, quinidine, quinina, verapamil.
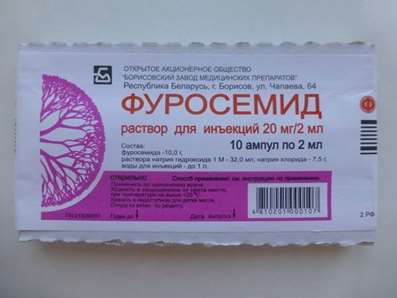
Los estudios especiales han mostrado que ondansetron no se relaciona con el alcohol, temazepam, furosemide, tramadol y propofol (diprivanom).
Además para p-Real-Academia-de-Bellas-Artes para iv y / m de administración
Phenytoin, carbamazepine y rifampicin
En pacientes que reciben inducers CYP3A4 potente (phenytoin, carbamazepine y rifampicin), la concentración de ondansetron en la sangre se disminuyó.
Tramadol
Hay datos de pequeños estudios que indican que ondansetron puede reducir el efecto analgésico de tramadol.
Compatibilidad farmacéutica con otras medicinas
ZofranŽ en una concentración de 16 μg / ml y 160 μg / ml (correspondiente a 8 mg. / 500 ml y 8 mg. / 50 ml, respectivamente) es farmacéuticamente compatible y se puede administrar vía el inyector Y-shaped intravenosamente con las medicinas siguientes:
- cisplatin (en una concentración de hasta 0.48 mg. / ml) durante 1-8 horas;
- 5-fluorouracil (en una concentración de hasta 0.8 mg. / ml a un precio de 20 ml / h - las concentraciones más altas del 5-fluorouracil pueden causar la precipitación de ZofranŽ);
- carboplatin (en una concentración de 0.18-9.9 mg. / ml) durante 10-60 minutos;
- etoposide (en una concentración de 0.144-0.25 mg. / ml durante 30-60 minutos);
- ceftazidime (en una dosis de 0.25-2 g, como una IV inyección bolus durante 5 minutos);
- cyclophosphamide (en una dosis de 0.1-1 g, como una IV inyección bolus durante 5 minutos);
- doxorubicin (en una dosis de 10-100 mg., como una IV inyección bolus durante 5 minutos);
- dexamethasone: inyección iv posible de 20 mg. dexamethasone despacio, durante 2-5 minutos. LS se puede administrar a través de un cuentagotas solo, mientras la concentración de fosfato de sodio dexamethasone en la solución se puede extender de 32 μg a 2.5 mg. / ml, Zofran Ž de 8 μg a 1 mg. / ml.
La medicación y administración
Solución para IV y administración IM
Náusea y vómitos causado por quimioterapia y / o radioterapia
La opción del régimen de la dosis es determinada por el nivel de emetogenicity de la terapia del antitumor.
Adultos
Quimioterapia de Emetogenic y radioterapia. La dosis recomendada es 8 mg., administrados despacio IV o IM justo antes de quimioterapia o radioterapia.
Muy quimioterapia vomitiva. Para pacientes que reciben muy emeticogenic quimioterapia, por ejemplo cisplatin en dosis altas, pueden dar ZofranŽ como un single IV o inyección IM en una dosis de 8 mg. justo antes de la quimioterapia. ZofranŽ en una dosis de 8 a 32 mg. sólo debería ser administrado por IV infusión después de disolver la medicina en 50-100 ml de una solución del cloruro de sodio del 0.9% u otra solución de infusión compatible durante 15 minutos o más. Otro método es administrar ZofranŽ 8 mg. despacio IV o IM inmediatamente antes de la quimioterapia, seguida de la administración de dos inyecciones IV o IM en una dosis de 8 mg. a intervalos de 2-4 horas o utilización de una infusión constante de la medicina A un precio de 1 mg. / h durante 24 horas.
En caso de muy emeticogenic terapia del antitumor, la eficacia de ZofranŽ puede ser realzada por una inyección intravenosa sola adicional de fosfato de sodio dexamethasone en una dosis de 20 mg. antes de la quimioterapia. Las formas de la dosis orales o rectales de ZofranŽ se recomiendan impedir retrasado o siguieron vomitando después del primer día después de la quimioterapia.
Niños y adolescentes (de edad de 6 meses a 17 años). Para niños con una área de superficie del cuerpo de menos de 0.6 m2, dan una dosis inicial de 5 mg. / m2 IV inmediatamente antes de la quimioterapia, seguida de ZofranŽ dentro en una dosis de 2 mg. (en la forma de un jarabe) después de 12 horas. Dentro de 5 días después de que la terapia de Tratamiento de curso sigue, tomando ZofranŽ dentro en una dosis de 2 mg. 2 veces por día.
Los niños con una área de superficie del cuerpo de 0.6-1.2 m2 ZofranŽ se administran iv una vez en una dosis de 5 mg. / m2 inmediatamente antes de la quimioterapia, seguida tomando la medicina dentro en una dosis de 4 mg. después de 12 horas. Tomando ZofranŽ oralmente en una dosis 4 mg. 2 veces por día se pueden seguir durante más 5 días después del curso de la quimioterapia.
Para niños con una área de superficie del cuerpo de más de 1.2 m2, dan una dosis inicial de 8 mg. IV inmediatamente antes de la quimioterapia, seguida tomando la medicina dentro en una dosis de 8 mg. después de 12 horas. ZofranŽ consumo oral en una dosis de 8 mg. 2 veces por día se puede Seguir durante 5 días después del curso de la quimioterapia.
Como una alternativa a niños de edad de 6 meses y más viejo, dan ZofranŽ IV una vez una dosis de 0.15 mg. / kilogramo (no> 8 mg.) inmediatamente antes de la quimioterapia. Esta dosis se puede administrar repetidamente cada 4 horas, no más de tres dosis en total. La toma de ZofranŽ dentro en una dosis de 4 mg. 2 veces por día se puede seguir durante más 5 días después del curso de la quimioterapia. Las dosis no deberían exceder recomendado para adultos.
Pacientes de edad avanzada. La corrección de ZofranŽ no se requiere.
Pacientes con función renal perjudicada. La corrección de ZofranŽ no se requiere.
Pacientes con función del hígado perjudicada. Clearance ZofranŽ considerablemente se reduce, el período de vida media se aumenta en pacientes con la disfunción del hígado moderada y severa. La dosis diaria de ZofranŽ no debería exceder 8 mg.
Pacientes con un metabolismo lento de sparteine / debrisoquine
En pacientes con un metabolismo lento de sparteine y debrisoquine, el período de vida media de ondansetron no se cambia. Por consiguiente, con la administración repetida de ZofranŽ a tales pacientes, su concentración en el plasma no se diferenciará de esto en la población en general. Por lo tanto, tales pacientes no tienen que ajustar la dosis diaria o frecuencia ondansetron.
Náusea postvigente y vómitos
Adultos. Para prevenir la náusea y vomitando en el período postvigente, una inyección intravenosa intravenosa o lenta sola de ZofranŽ en una dosis de 4 mg. se recomienda durante la anestesia de inducción.
Para el tratamiento de la náusea y vomitando en el período postvigente ZofranŽ se administra una vez en una dosis de IM de 4 mg. o despacio IV.
Niños y adolescentes (de edad de 1 mes a 17 años). Para prevenir la náusea y vomitando en el período postvigente en niños que se someten a la intervención quirúrgica bajo la anestesia general, ZofranŽ se puede administrar en una dosis de 0.1 mg. / kilogramo (máximo a 4 mg.) en la forma de una inyección intravenosa lenta antes, durante o después de una Anestesia introductoria o después de la cirugía. Para el alivio de náusea y vómitos que se desarrollan en el período postvigente, una inyección intravenosa lenta de ZofranŽ en una dosis de 0.1 mg. / el kilogramo (máximo a 4 mg.) se recomienda.
Pacientes de edad avanzada. Allí se limita experiencia con ZofranŽ para prevenir y detener la náusea postvigente y vomitando en los ancianos, aunque ZofranŽ sea bien tolerado por pacientes más de 65 años de la edad quienes reciben la quimioterapia.
Pacientes con función renal perjudicada. La corrección de ZofranŽ no se requiere.
Pacientes con función del hígado perjudicada. Clearance ZofranŽ considerablemente se reduce, el período de vida media se aumenta en pacientes con la disfunción del hígado moderada y severa. La dosis diaria de ZofranŽ no debería exceder 8 mg.
Pacientes con un metabolismo lento de sparteine / debrisoquine. En pacientes con un metabolismo lento de sparteine y debrisoquine, el período de vida media de ondansetron no se cambia. Por consiguiente, con la administración repetida a tales pacientes, su concentración plasma no se diferenciará de esto en la población en general. Por lo tanto, tales pacientes no tienen que ajustar la dosis diaria o frecuencia ondansetron.
Compatibilidad farmacéutica
Para diluir la solución de inyección, las soluciones siguientes se pueden usar:
- Solución del 0.9% de cloruro de sodio;
- Solución de la dextrosa del 5%;
La solución del dispositivo de llamada;
- El 10% mannitol solución;
- Solución del cloruro del potasio del 0.3% y solución del cloruro de sodio del 0.9%;
- Solución del cloruro del potasio del 0.3% y solución de la dextrosa del 5%.
La solución de infusión debería estar preparada inmediatamente antes del uso. Si es necesario, la solución de infusión confeccionada se puede almacenar para un máximo de 24 horas a una temperatura de 2-8 ° C. Durante la infusión, la protección de la luz no se requiere; La solución de inyección diluida retiene su estabilidad durante al menos 24 horas bajo luz natural o luz normal.
Pastillas para resorción y jarabe
La pastilla para la resorción se coloca en la punta de la lengua, después de disolverlo se traga.
Náusea y vomitando en quimioterapia cytostatic o radioterapia
La opción del régimen de la dosis es determinada por el emetogenicity de la terapia del antitumor.
Adultos: La dosis diaria, por regla general, es 8-32 mg.
Los modos siguientes se recomiendan:
- con quimioterapia emetogenic moderada y radioterapia, la dosis recomendada es 8 mg. ondansetron 1-2 horas antes del principio de la terapia principal con el consumo subsecuente de más 8 mg. oralmente después de 12 horas;
- con muy la quimioterapia vomitiva, la dosis recomendada es 24 mg. de ondansetron concomitantly con dexamethasone en una dosis de 12 mg. 1-2 horas antes del principio de la quimioterapia.
Para impedir tarde o vómitos prolongados que ocurren después de 24 horas, ZofranŽ se debería tomar internamente en una dosis de 8 mg. dos veces al día durante 5 días.
Children ZofranŽ por lo general se administra como una inyección para 5 mg. / m2 una vez, IV, inmediatamente antes del principio de la quimioterapia, seguida de la ingestión en una dosis de 4 mg. después de 12 horas. Después de completar el curso de quimioterapia, es necesario seguir tomando ZofranŽ en una dosis 4 mg. 2 veces por día durante 5 días.
Náusea y vomitando en el período postvigente
Recomiendan a adultos prevenir la náusea y vomitando en el período postvigente ZofranŽ de 16 mg. dentro de 1 hora antes de la anestesia.
Para parar náusea postvigente y vómitos, la solución de ZofranŽ para inyecciones se usa.
Dan a niños para prevenir y parar la náusea postvigente y ZofranŽ que vomita como una IV inyección.
Pacientes de edad avanzada. Los ajustes de la dosis no se requieren.
Pacientes con insuficiencia renal. Ningunos cambios especiales de dosis, frecuencia o método de la administración se requieren.
Pacientes con función del hígado perjudicada. La dosis diaria de ondansetron no debería exceder 8 mg.
Pacientes con un metabolismo lento de sparteine / debrisoquine. La corrección de una dosis diaria o la frecuencia de ondansetron no se requieren.
Supositorios
Náusea y vomitando en quimioterapia cytostatic o radioterapia
La opción del régimen de la dosis es determinada por el emetogenicity de la terapia del antitumor.
Para adultos, los modos siguientes se recomiendan:
- con quimioterapia emetogenic moderada o radioterapia 16 mg. ondansetron (1 supp.) 1-2 horas antes del principio de la terapia principal.
- con muy la quimioterapia vomitiva, la dosis recomendada es 16 mg. (1 supp.) Simultáneamente con IV inyección de 20 mg. dexamethasone 1-2 horas antes del principio de quimioterapia.
Para impedir tarde o vómitos prolongados que ocurren 24 horas después del final de quimioterapia o radioterapia, siga tomando la medicina en una dosis de 16 mg. (1 sopa.) Una vez al día durante 5 días. En vez de supositorios, ZofranŽ también se puede administrar oralmente en la forma de pastillas o jarabe.
Niños. ZofranŽ en supositorios no se recomienda para el uso en niños.
Children ZofranŽ se prescribe en otras formas de la dosis: pastillas o jarabe para administración oral o solución para administración parenteral.
Pacientes de edad avanzada. Los ajustes de la dosis no se requieren.
Pacientes con insuficiencia renal. Ningunos cambios especiales de dosis, frecuencia o método de la administración se requieren.
Pacientes con función del hígado perjudicada. El uso de supositorios no se recomienda, porque La dosis diaria de ondansetron para esta categoría de pacientes no debería exceder 8 mg. / día.
Pacientes con un metabolismo lento de sparteine / debrisoquine. La corrección de una dosis diaria o la frecuencia de ondansetron no se requieren.
Sobredosis
Síntomas: en mayoría de los casos, son similares a reacciones adversas cuando la medicina se usa en las dosis recomendadas. Hay experiencia limitada de la sobredosis ondansetron.
Tratamiento: no hay antídoto específico para ZofranŽ, por tanto se recomienda que la terapia sintomática y soportante se proporcione a la sobredosis sospechada. ipecacuanum de uso en caso de la sobredosis de ZofranŽ no se debería tomar. Su eficacia es improbable en relación al efecto antivomitivo de ZofranŽ.
Instrucciones especiales
Las reacciones alérgicas a ondansetron en pacientes con una historia de hipersensibilidad frente a otro 5HT3 antagonistas del receptor se han notado.
Ya que el ondansetron aumenta el tiempo de paso de los contenidos a lo largo del intestino grueso, pacientes con signos de la obstrucción intestinal después de que el uso de la medicina requiere la observación regular.
Las pastillas para la resorción contienen aspartame, y por lo tanto se deberían tomar con la precaución contra pacientes con phenylketonuria.
Las pastillas para la resorción no se deberían apretar de antemano de la hoja de metal, se toman inmediatamente antes del uso.
Actualmente, hay datos limitados en el uso de ondansetron (rp para IV y yo / O administración) en niños más jóvenes que 1 mes.
Precauciones farmacéuticas
ZofranŽ no se debería administrar en la misma jeringuilla o en una solución de infusión con otras medicaciones.
Influencia en la capacidad de conducir y trabajar con maquinaria móvil
ZofranŽ no tiene un efecto sedativo y no afecta la capacidad de pacientes de conducir vehículos o tomar parte en otras actividades potencialmente arriesgadas que requieren la concentración aumentada y la velocidad de reacciones psicomotores.
Condiciones de almacenaje de la medicina Zofran
En el lugar oscuro a una temperatura de no más alto que 30 ° C.
Manténgase fuera de alcance de los niños.
Tiempo de durabilidad antes de la venta de la medicina Zofran
3 años.
No use después de que la fecha de caducidad imprimió en el paquete.

 Tu cesta
Tu cesta